Unterabschnitte von Technik
Ausruestung
Unterabschnitte von Ausruestung
Seitliche Stereo-Mikroskop-Beleuchtung
Eines der Hauptprobleme bei der Präparation von Gastrotrichen ist, die Tiere in einer Wasserprobe aufzuspüren und auf einen Objektträger zu pipettieren. Da Gastrotrichen transparent sind, sind sie in einem Stereo-Mikroskop mit traditioneller Auflicht- oder Durchlichtbeleuchtung nahezu unsichtbar. Die Tiere werden erst bei einer Dunkelfeldbeleuchtung sichtbar.
Im professionellen Bereich wird eine Dunkelfeldbeleuchtung durch Kaltlichtleiter realisiert. Eine Alternative Möglichkeit bieten LED-Leuchten mit Schwanenhals, die die Probe seitlich beleuchten. Durch diese seitliche Beleuchtung gelangt nur das an den Objekten gestreute Licht in das Objektiv des Mikroskops. Der Hintergrund bleibt reinschwarz. Da die Lampen nicht an der Probe befestigt sind, ändert sich die Beleuchtungsstärke und der Schattenwurf abhängig von der Probenposition. Oft stellen die Lampen auch ein mechanisches Hindernis bei der Verschiebung des Probengefäßes dar. Meist ist diese Art der Beleuchtung bei Stereo-Mikroskopen nicht verfügbar und muss nachgerüstet werden.
Um diese Nachteile zu minimieren, habe ich für diesen Zweck habe ich eine seitliche Dunkelfeldbeleuchtung entwickelt, die mit einfachen Mitteln und einem 3D-Drucker leicht realisiert und an jedes Stereo-Mikroskop angepasste werden kann.

Halter für LED-Streifen
Drehbarer Objektführer
Um Objektträger entsprechend dem DIK-Gradienten oder dem Bildrändern der Kamera auszurichten, ist es nötig, die Präparate auf dem Objekttisch zu drehen. Wenn man - wie ich - keinen Drehtisch zu Verfügung hat muss man sich was einfallen lassen…
Ich habe mir einen drehbaren Objektführer konstruiert, der problemlos mit einen einfachen 3D-Drucker gefertigt werden kann. Dabei wurden folgende Eigenschaften berücksichtigt:
- geringe Bauhöhe - dadurch sind Kollisionen mit den Objektiven ausgeschlossen
- montiert an den Kreuztisch, um die Präparate weiterhin verschieben zu können
- Präparat liegt direkt auf dem Objekttisch auf - keine Problem mit der Scharfstellung des Kondensors / Köhlern ist möglich
- leichtes Einsetzen und Entnehmen des Objektträgers
- abweichende Maße der Objektträger durch Federhalterung möglich
- Einsetzen von den handelsüblichen Kunststoff-Petrischalen mit 7 cm Durchmesser möglich; zusätzliche kreisförmige Aussparung für die Verwendung der Deckel der Petrischalen (deren Bauhöhe etwas kleiner ist, so dass es zu keiner Kollision mit dem 10er Objektiv kommen kann)
Der Objektführer besteht aus zwei separaten Teile:
- einem Drehrahmen der an den Kreuztisch mit den üblichen Befestigungsschrauben fixiert wird
- einer Drehscheibe, die in den Rahmen gesetzt wird und in ihm gedreht werden kann. Um die Drehung zu erleichtern, liegt die Drehscheibe nur an sechs Punkten an dem Rahmen an. Die Drehscheibe ist mit sechs Griffen versehen, so dass sie leicht von allen Seiten bedient werden kann

Bild 1: Einzelteile des Objektführers; links Rahmen, der an den Kreuztisch montiert wird; rechts die Drehscheibe, die den Objektträger bzw. die Petrischale hält
Die beiden Teile werden ineinander gesteckt. Der Objektträger sitzt fest in der Aussparung und kann um 360 Grad gedreht und wie gewünscht ausgerichtet werden. Die runden Aussparungen sind ggf. für Petrischalen vorgesehen.
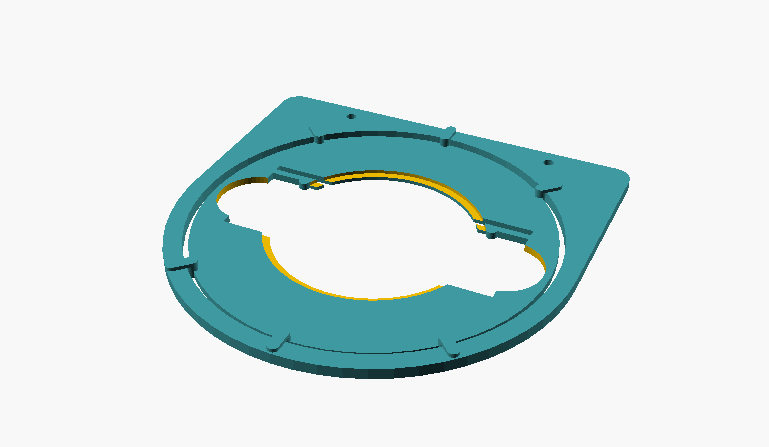
Bild 2: zusammengesteckter Objektführer
Am Mikroskop sieht das ganze dann so aus:

Bild 3: Drehbarer Objektführer am Mikroskop
In der Praxis hat sich diese Konstruktion bewährt. Natürlich ist der Drehtisch nicht zentrierbar - beim Drehen muss die Position des Objektes durch den Kreuztisch nachgeregelt werden. Die Objektträger sitzen fest genug, so dass es keinerlei “Schlupf” beim Verschieben gibt. Einige Objektträger-Marken scheinen aber eine etwas geringere Tiefe aufzuweisen, so dass man sich bei diesen wünscht, dass sie etwas straffer sitzen sollten. Will man solche Objektträger verwenden, muss man die Haltefedern etwas anpassen…
Die entsprechenden Druckfiles - inklusive den CAD-Files im OpenSCad-Format können bei Thingiverse heruntergeladen werden. Die Konstruktion ist auf den Objektisch meines Ortholux II angepasst. Für andere Mikroskope muss die Position bzw. der Durchmesser der Halteschrauben ggf. angepasst werden.
Ich möchte diesen praktischen Objektführer nicht mehr missen. Erst durch das Drehen des Objekts in den optimalen Winkel ist z.B. eine optimale Kontrastierung bei DIK möglich. Auch das Ausrichten an den Foto-Rändern erspart das ständige Drehen der Kamera.
Blitz
Die Vor- und Nachteile einer Mikroblitz-Einrichtung am Mikroskop wurde bereits in mehreren Beiträgen eingehend beleuchtet. Für mich als “Tümpler” war ausschlaggebend, dass ein Mikroblitz
- es erlaubt, mit minimaler Lichtstärke (des Pilotlichtes) zu beobachten. Leider gibt es viele Organismen, die die oft hohen Lichtstärken, die bei DIK nötig sind, nicht gut vertragen und in Panik dem Licht ausweichen oder gar die Beleuchtung nicht überleben.
- einen konstanten, von der Lichtstärke des Pilotlichts unabhängigen Weißabgleichs der Fotos gewährleistet.
- kurze Belichtungszeiten unabhängig vom Pilotlicht ermöglicht. Will man mit der “normalen” LED-Beleuchtung kurze Belichtungszeiten realisieren, muss man vor dem Auslösen der Kamera typischerweise auf maximale Lichtstärke stellen, die aber für die Beobachtung unangenehm ist. Nur so erreicht man dann Belichtungszeiten kleiner als 1/500 s, die für ein “Einfrieren” der Bewegungsunschärfe nötig ist.
- Bewegungsunschärfen mit den typischen Brenndauern von kleiner als 1/2000 bei ISO 100 minimiert. Mit LED-Beleuchtung erreiche ich bei 100er DIK bei ISO 400 typischerweise nur 1/200 s.
Deshalb habe ich mir Blitzeinrichtung für mein Ortholux II mit meinem 3D-Drucker konstruiert!
Bei einem Mikroblitz hat man prinzipiell die recht einfache Möglichkeit, den Blitz seitlich unter dem Kondensor einzuspiegeln. Ein solches Setup ist aber eher provisorisch, da beim “Normalbetrieb” Blitz und Strahlteiler unter dem Objekttisch stören und die ergonomische Bedienung einschränken. Für einen dauerhaft angebauten Mikroblitz an einem Mikroskop mit separaten Lampenhaus haben sich die “Stahlschmidt’schen Blitzwürfel” bewährt, die zwischen Lampenhaus und Stativ eingefügt werden und hier den Blitz in den “normalen” Strahlengang einspiegeln. So ist auch eine Blitzbeleuchtung unter “Köhlerbedingung” möglich, da die bestehende Leuchtfeldblende auch für den Blitz genutzt wird. Also musste es eine ähnliche Blitzwürfel-Lösung werden, bei dem die nötigen mechanischen Komponenten mit einem 3D-Drucker erstellt werden sollten. Meine Lösung sieht so aus:
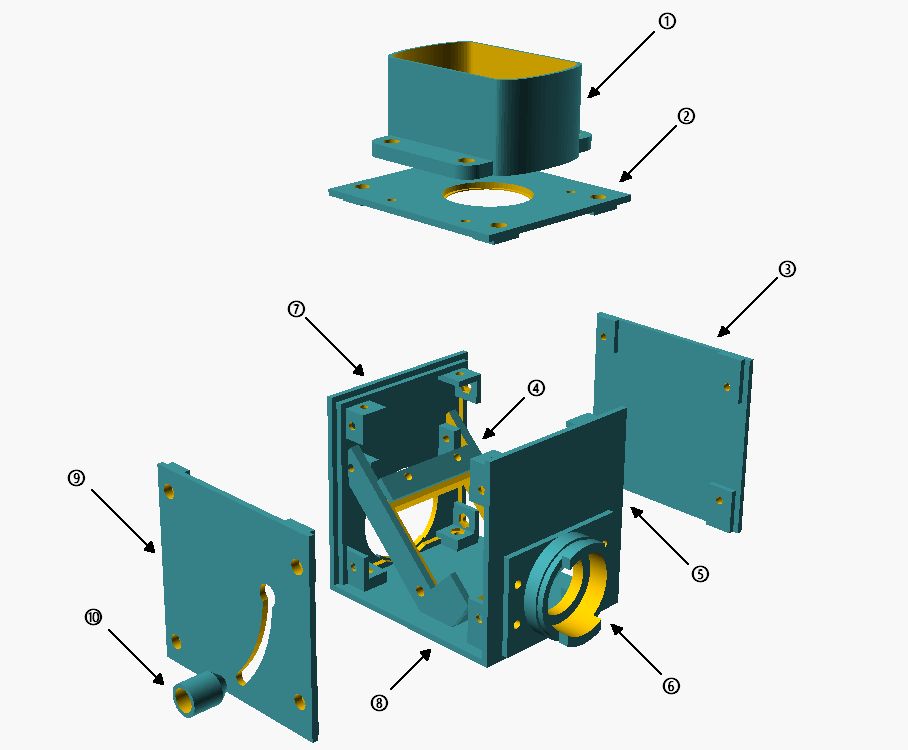
Explusionszeichnung des Blitzwürfels: 1: Blitzhalter; 2: Deckel; 3: Seitenwand; 4: drehbarer Halter des Strahlteilers; 5: Wand Stativseite; 6: Lampenbajonett Stativseite; 7: Wand Lampenseite; 8: Bodenplatte; 9: Seitenwand mit Schwenkgriff; 10: federbelasteter Griff
Die zentrale Komponente ist der Halter des Strahlteiler (4), der schwenkbar ausgeführt würde. Dadurch ist es möglich, den Strahlteiler aus dem Strahlengang zu entfernen und den Beleuchtungsstrahlengang auch ohne Beeinträchtigungen durch den Blitz zu betreiben. Um einen sicheren Halt des ausgeschwenkten Strahlteilers zu gewährleisten, wurde der Schwenkgriff (10) mit einer Feder auch der Schwenkachse befestigt, so dass er gegen die Seitenwand drückt und in der oberen Stellung in die Aussparung einrastet. Zum Einschwenken des Strahlteiler muss der Griff nach Außen gezogen werden um eine freie Bewegung zu ermöglich. Lampen- und stativseitig wurden die Würfelwände (6 und 7) entsprechend den Maßen für das Lampenbajonett beim Ortholux II ausgeführt. Dadurch kann der Blitzwürfel zwischen Lampe und Stativ fest montiert werden und beeinträchtigt die Bedienung des Mikroskops nicht weiter. Die Lichtöffnung (2) am Deckel des Blitzwürfels wurde so an die Maße der Kollektorlinse angepasst, dass man sie einfach direkt einlegen kann. Bei einem Transport sollte deshalb die Kollektorlinse entfernt werden, da sie nur durch die Schwerkraft gehalten wird. Durch diese Konstruktion sitzt der Blitz direkt auf der Kollektorlinse und der Abstand zur Blitzröhre ist nahezu optimal. Durch die Fresnel-Platte des Blitzes können keine Störungen im Bild entstehen, da sie sehr nahe an der Kollektorlinse sitzt und deshalb nicht scharf abgebildet wird. Auf der Oberseite wird ein Halter (1) für den Blitz angeschraubt, der natürlich auf die Maße des verwendeten Blitzgeräts angepasst ist.
Zusammengebaut sieht das ganze dann so aus:

Gesamtansicht
Die Außenmaße (ohne Blitzhalter) des Blitzwürfels betragen 90mm * 100mm * 105mm - es handelt sich also eigentlich um einen “Blitzquader”. Diese Maße sind durch die Abmessungen der Zukaufteile (Strahlteiler, Kollektorlinse, Blitz) und die Vorgaben des Lampenbajonetts bedingt. In der Realität am Mikroskop sieht die Mikroblitzeinrichtung dann so aus:

Blitz am Ortholux II
Als Blitz verwende ich einen Godox TT685II für Canon-Kameras mit drahtloser Fernsteuerung, der problemlos mit meiner EOS700D zusammen arbeitet. Der Blitz hat eine Leitzahl von 60 und damit genügend Power, um beim 100er DIK noch mit 1/8 der Maximalleistung richtig zu belichten. Ich betreibe den Blitz im TTL-Modus, der problemlos die Blitzstärke an Motiv / Objektiv anpasst. Lediglich eine Belichtungskorrektur von -1.7 EV musste eingestellt werden. Dies Belichtungskorrektur ist unabhängig vom verwendeten Objektiv, muss aber - wie bei normalen Fotos auch - manchmal ans Motiv angepasst werden. Um den Blitz mit einem Netzteil zu betreiben, habe ich die Batterien mit Batteriedummies ersetzt, an die ein 6V Netzteil angeschlossen sind. Für alle, die sich an einen Nachbau wagen wollen, habe ich die entsprechenden OpenSCAD-Dateien hier zum Download zusammengestellt. Eine Anpassung an die Geometrie anderer Strahteiler, Kollektorlinsen und Blitzgeräte ist problemlos möglich. Schwieriger wird die Anpassung an Lampenbajonette Mikroskop-Hersteller. Das ist zwar prinzipiell möglich, erfordert aber u. U. Änderungen der Strahlführung, da sich dann möglicherweise die Lage der Lichtachse ändert. Bei Problemen einfach nachfragen - alles ist irgendwie möglich…
Ich bin mit dieser Mikroblitz-Lösung sehr zufrieden und möchte sie nicht mehr missen. Leider fällt damit eine weitere Ausrede für meine Foto-Qualität weg - jetzt muss ich wohl doch lernen, wie man gute Fotos macht…
Deckglas-Kompressorium
Um lebende Gastrotrichen detailliert mikroskopisch zu beobachten, ist es nötig,
- dies Schichtdicke zu minimieren, da nur so die optimalen optischen Bedingungen für Objektive mit großen Vergrößerungen gewährleistet werden können
- die Tiere unbeweglich festzuhalten
- die Austrocknung der Präparate soweit zu minimieren, dass eine bequeme Beobachtungsdauer erreicht werden kann
- das Eindringen von Immersionsöl in das Präparat zu verhindern
Zu diesem Zweck habe ich das Deckglass-Kompressorum entwickelt, das diese Bedingungen sehr einfach und schnell erreichen lässt.
Zunächst ist es wie immer nötig, das Beobachtungsobjekt mit einer dünnen Pipette unter dem Stereo-Mikroskop zu isolieren und mit einem möglichst kleinen Wassertropfen auf eine gereinigten Objektträger aufzubringen. Dabei sollte darauf geachtet werden, dass der Wassertropfen so knapp bemessen wird, dass die Wasserschicht unter dem aufzubringendem Deckglas bei der gewünschten Schichtdicke die Ränder des Deckglases nicht erreicht. Hierzu ist etwas Erfahrung nötig…

Deckglas-Kompressorium: Vaselinestege in gelb
In diesem Zustand ist der im Wassertropfen gefangene Gastrotrich noch frei beweglich und kann bequem mit schwächeren Objektiven beobachtet werden. Durch die kleine Fläche des Wassertropfens ist das Auffinden des Objektes problemlos möglich.
Unter Mikroskopkontrolle kann man nun vorsichtig die Schichtdicke des Wassers durch Festdrücken der Deckglasränder gerade soweit verringern, dass der Gastrotrich nicht mehr beweglich ist und sanft durch das Deckglas auf den Objektträger gedrückt wird. Die beiden Vaseline-Ränder setzen dabei dem manuellen Druck genügend Widerstand entgegen um die Schichtdicke sehr kontrolliert verringern zu können. Durch die beiden gegenüber liegenden Vaselineränder wird gewährleistet, dass
- das Eintrocknen des Präparates stark verzögert wird, da eine Verdunstung des Wassers nur an den freiliegenden Deckglasrändern ohne Vaseline erfolgt und deshalb stark reduziert ist.
- die eingestellt Schichtdicke sich beim Austrocknen des Präparates nahezu unverändert bleibt, da der Wassertropfen nur an den Rändern verdunstet und sich lediglich sein Durchmesser ändert.
- ein Eindringen von Immersionsöl an den abgedichteten Deckglaskanten unmöglich ist, an den freiliegenden meist keinen Kontakt mit dem Probenwasser besteht.
- ein “Durchziehen” von Chemikalien zum Färben etc. wegen der gegenüberliegenden offenen Deckglaskanten problemlos möglich ist.
- ein späteres manuelles Verringern der Schichtdicke bis zum Plattdrücken des Objektes (z. B. zur Schuppenanalyse jederzeit kontrolliert möglich ist
Mit etwas Erfahrung ist die Erstellung eine Deckglas-Kompressoriums problemlos und innerhalb von wenigen Sekunden möglich.
Ich verwende dies Präparationsart für hochauflösende Beobachtungen seit Jahren und möchte sie nicht mehr missen!
Doppeltes Deckglas
Gastrotrichen sind Tiere, bei denen sich die Ober- und Unterseite stark unterscheiden. Oft ist es nötig, sowohl die ventrale als auch die dorsale Seite genau zu beobachten. Wenn man eine Tier mit einem Deckglas-Kompressorium beobachtet, kann meist nur eine Seite exakt beobachtet werden. Die andere Seite ist nur zugänglich, wenn man durch das Tier hindurch fokussiert. Dies hat aber - gerade bei hoch auflösenden Objektiven - große optische Qualitätseinbußen zufolge. Man kann dann nur versuchen, das Tier durch Verschieben des Deckglases zu drehen. Leider hat diese Methode aber nur bei drehrunden Objekten eine Aussicht auf Erfolg und endet bei Gastrotrichen meist letal… :cry:

diagonales doppeltes Deckglas
Vaselinesteg in gelb
Das Objekt kann nun mit der gewohnten optischen Qualität an der Oberseite beobachtet werden. Ist die Beobachtung von dieser Seite aus beendet, wird (wenn noch nicht erfolgt) ein Tropfen Immersionsöl auf das Deckglas gegeben und der Deckglasstapel an den überstehenden Ecken vom Objektträger gelöst. Der Stapel wird gedreht und mit der eingeölten Seite auf den Objektträger gelegt. Jetzt kann die Beobachtung von der nun oben liegenden, früheren Unterseite aus erfolgen. Durch die Verwendung unterschiedlicher Deckglasgrößen wird sichergestellt, dass man beim Drehen des Deckglasstapel nur ein Deckglas berührt und die Deckgläser nicht gegeneinander verschiebt.
Mikroaquarium
Unter Mikroaquarien verstehe ich Präparate in Objektträgergröße, die man direkt mit dem Mikroskop beobachten kann. Dabei sollte die optische Qualität der Mikroaquarien (speziell die Schichtdicke) gut genug sein, um jede mögliche Vergrößerung zu verwenden. Außerdem sollte die Lebensdauer der Organismen zumindest einige Wochen betragen, um das Verhalten bzw. die Entwicklung der Objekte studieren zu können. Nicht zuletzt muss das Verfahren einfach und schnell anwendbar sein - ein umständliches und mit einem hohen apparativen Aufwand verbundenes Verfahren ist in meinen Augen im Amateurbereich nicht praktikabel.
Vor einigen Jahren bin ich im Internet auf eine Präparationsmethode gestoßen, die ich zu einem Langzeit-Mikroaquarium weiterentwickeln konnte. Ein solches Mikroaquarium ist folgendermaßen aufgebaut:
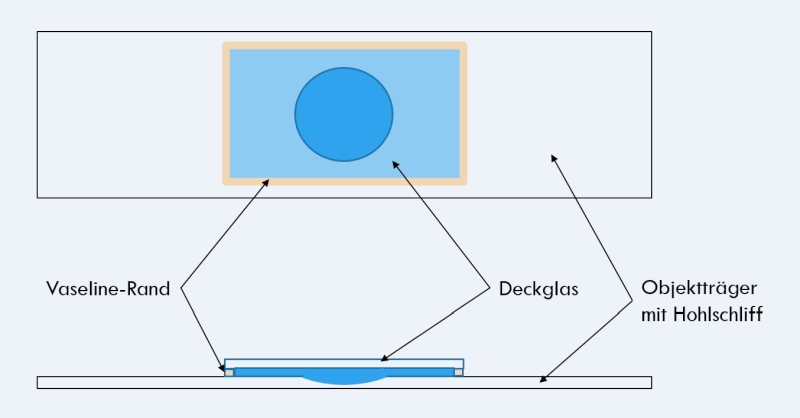
Aufbau eines Mikroaquariums
Die Lebensdauer eines “normalen”, temporären Tümpler-Präparates kann erhöht werden, wenn man das Verdunsten des Wasser effektiv verhindert. Dies kann erreicht werden, wenn man das Deckglas mit einem Vaseline-Rand wasserdicht versiegelt. Vaseline besitzt zu diesem Zweck eine Reihe von idealen Eigenschaften:
- sie ist absolut wasserdicht
- Vaseline ist luftdurchlässig (kennt man von Feuchtigkeitscremes auf Vaselinebasis)
- wegen ihrer Konsistenz ist Vaseline leicht zu verarbeiten
- sie ist in jedem Drogerie-Mark preiswert zu finden
Um das Deckglas mit einem Vaselinerand zu versehen, trägt man einen dünnen (!) Vaselinefilm auf seinen Handballen auf und streift mit jedem Deckglasrand einen dünnen Steg von der Haut ab. Das Deckglas kann dann direkt mit einem Rand auf den Objektträger (mit Probe) gesetzt werden. Von diesem Rand aus senkt man das Deckglas ab und drückt das Deckglas mit einem Holzstäbchen langsam auf die gewünschte Schichtdicke zurecht. Überschüssiges Wasser wird dadurch unter dem Deckglas heraus gedrückt und kann dann leicht entfernt werden.
Um ein langlebiges Mikroaquararium zu erstellen, ist es nötig eine relativ große Wassermenge im Präparat einzuschließen. Ist dieser Wasserpuffer zu gering, würden die Organismen nach wenigen Tagen versterben. Deshalb verwendet man für ein Mikroaquarium einen Objektträger mit Hohlschliff. Um die zur Beobachtung nutzbare Fläche zu erhöhen, verwende ich ein möglichst großes Deckglas (z. B. 24mm x 32 mm oder 24mm x 60mm). Dadurch ist die Fläche außerhalb des Hohlschliffs - die Fläche mit der optimalen Schichtdicke - maximiert.
Ein so erstelltes Mikroaquarium hat viele Vorteile:
- Lebensdauer der Organismen bis zu 6 Wochen
- große mechanische Stabilität:
- durch das festsitzende Deckglas kann ist die Reinigung problemlos
- senkrechte Aufbewahrung in normalen Präparateboxen (transparente Abdeckung!)
- absolut stabile Verhältnisse auch für Langzeit - Videoaufnahmen
- Einsatz von Immersionsöl unproblematisch: DG verrutscht nicht, Öl zieht nicht unter das Deckglas
- Zusatzaufwand zur Erstellung nur wenige Handgriffe
Der Hauptvorteil ist aber in meinen Augen, dass sich die Organismen nach einer Eingewöhnungszeit von ca. einem Tag in den Mikroaquarien “natürlich” verhalten. Die typische große Unruhe, wie man sie aus den “normalen”, temporären Tümpler-Präparaten kennt, ist abgeklungen und die eingeschlossenen Tiere gehen zu ihrem “Tagesgeschäft” über. Die meisten Ciliaten weiden ruhig ihre Nahrung ab oder stehen sogar über Stunden an dem selben Platz und strudeln entspannt ihr Futter ein. Gastrotrichen beruhigen sich und tauchen nach einiger Zeit aus ihren Verstecken auf und weiden - optimal beobachtbar - die Unterseite des Deckglases ab.
Um diese entspannten Verhältnisse in einem Mikroaquarium zu demonstrieren, möchte ich folgenden - nahezu unbearbeiteten Film - zeigen, der in mehreren Mikroaquarien einige Tage nach deren Erstellung aufgenommen wurde:
Zum Starten des Filmes bitte auf das Bild klicken!
Für mich ist diese Art der Präparation inzwischen die befriedigendste Art, die Wunderwelt im Tümpel zu beobachten. Natürlich ist es so nicht möglich, die letzten anatomischen Details der Organismen abzubilden. Dafür erhält man aber die Möglichkeit das Verhalten oder die Entwicklung der Organismen über einen langen Zeitraum und stressfrei zu verfolgen.
Schuppenpräparation
Bei Bauchhärlingen erfolgt die Arteinteilung traditionell über die Form der Schuppen. Daher ist die Artbestimmung oft nur möglich, wenn man die Schuppenform der Tiere genau beurteilen kann. Leider sind die Schuppen der Gastrotrichen oft nur schwer zu sehen. Selbst mit DIK - obwohl hier die schwache Doppelbrechung der Schuppen den Kontrast noch zusätzlich verstärkt - ist bei vielen Arten eine Lebendbeobachtung zur Artdiagnose nicht ausreichend. Deshalb möchte ich hier eine Möglichkeit zur Präparation der Schuppen und damit zur (meist) sicheren Artdiagnose vorstellen.
Als Beispiel habe ich
Lepidochaetus zelinkai
gewählt. Durch das markante Erscheinungsbild dieses Gastrotrichen ist eine Schuppenanalyse zur Artbestimmung eigentlich nicht nötig, aber einige Schuppendetails werden in der Literatur kontrovers diskutiert, so dass ich mir mal selbst ein Bild machen wollte.
L. zelinkai ist ein mittelgroßer Gastrotrich mit einem markanten Stachelkleid:

Bild 1:
L. zelinkai
: Übersicht
Selbst bei stärkerer Vergrößerung werden nicht alle Details der Beschuppung deutlich:
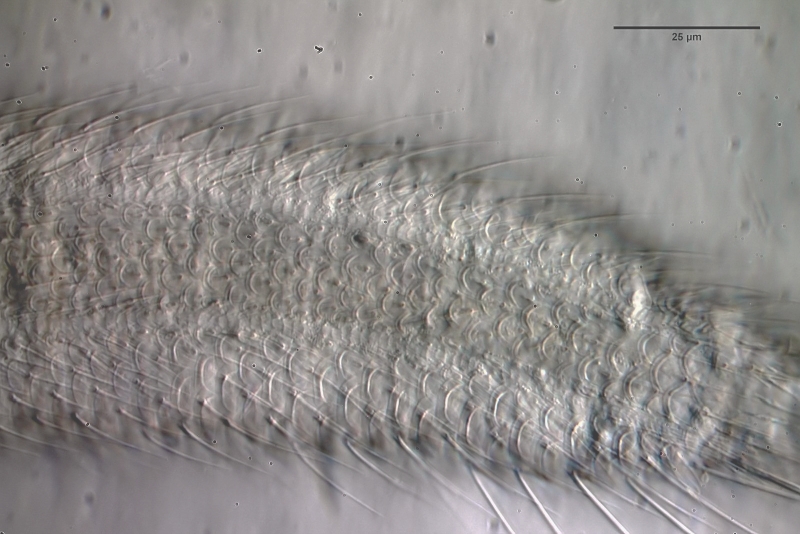
Bild 2:
L. zelinkai
: Schuppen des ventrales Zwischenfeldes
Um die Schuppen frei zu präparieren, muss das Tier mazeriert werden. Dazu legt man das Tier - am besten mit einem einfachen Vaseline-Kopressorium - mit dem Deckglas fest und zieht einen Tropen Eisessig unter das Deckglas. Den Eisessig habe ich vorab mit sehr wenig Eosin angefärbt - dadurch werden die Schuppen gleichzeitig bei der Mazeration gefärbt. Der Eisessig löst alle Weichteile des Tieres innerhalb weniger Minuten auf, während die Schuppen der Gastrotrichen säurebeständig sind und deshalb erhalten bleiben. Je nach Schuppengefüge verbleiben die Schuppen als zusammen hängende Hülle erhalten oder lösen sich voneinander. Bei L. zelinkai sind die Schuppen anscheinend nicht miteinander verzahnt, so dass die Schuppen sich verteilen:
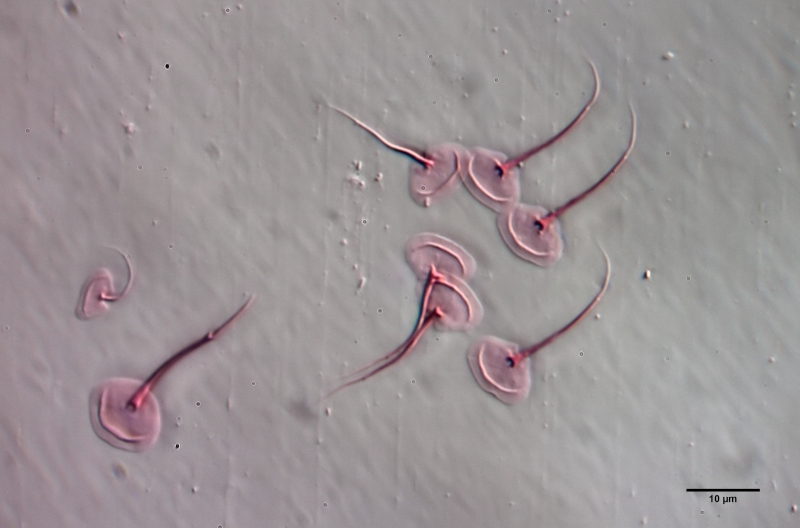
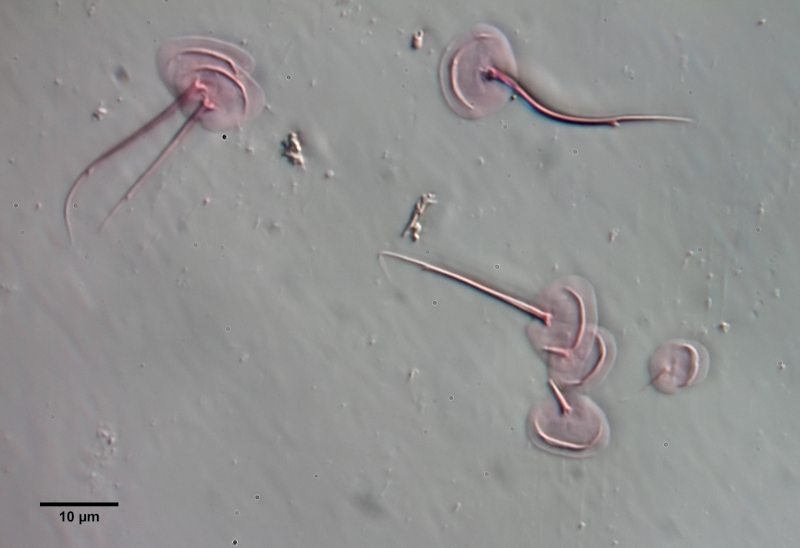
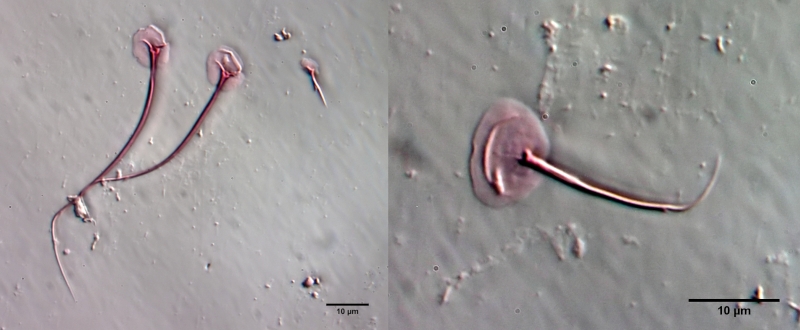
Diese Art der Präparation ist recht einfach und erlaubt es, die Schuppenformen genau zu beurteilen. So fallen z.B. bei den obigen Bildern die Stege in der Schuppenfläche auf, die sich parallel zur Vorderkante erstrecken. In der Literatur werden diese “doppelten Ränder” der Schuppen meist als optisches Artefakt angesehen, das durch den zweifachen Schnitt der Fokusebene durch die gebogenen Schuppen erzeugt wird. Die obige Schuppenanalyse belegt eindeutig, dass diese auffälligen Stege wirklich existieren und eine Verdickung der Schuppen darstellen.